 病因
病因
病因:
1.遗传因素
(1)组织相容性抗原:近年来通过免疫遗传研究测定,某些主要组织相容性复合体(major histocompatibility complex,MHC)基因的频率在干燥综合征患者中增高。人的MHC也称人类白细胞抗原(human leucocyte antigen,HLA),与干燥综合征相关的为HLA-DR3、HLA-B8。这种相关性可因种族的不同而不同。据报道在西欧白人干燥综合征中与HLA-B8、DR3、DRW52相关,在希腊则与HLA-DR5相关,在日本则与HLA-DR53相关,我国干燥综合征与HLA-DR8相关。男性患者则与DRW52相关。研究发现HLA基因与干燥综合征自身抗体的产生和临床表现也有相关性,如具有HLA-DR3、DQ1/DQ2的干燥综合征都具有高滴度的抗SSA、SSB抗体,临床症状较重,且都有血管炎的表现。这些均说明某些Ⅱ类HLA基因可能为干燥综合征易感性遗传标记,它们在干燥综合征的发病、临床表现与疾病持续中都起了重要作用。然而在非干燥综合征的健康人群中有相当一部分人也具有HLA-DR3或DR8。因此,遗传的基础仅是干燥综合征病因之一,尚需同时有其他因素参与方能造成干燥综合征的发病。
(2)家族史:干燥综合征患者中有姐妹、母女同时患病者,这也提示了本病的病因中有遗传因素。
2.病毒 认为有多种病毒与干燥综合征发病及病情持续可能有关。如EB病毒、疱疹病毒6型、巨细胞病毒、逆转录病毒等。
(1)Epstein-Barr(EB)病毒:它是一种常见的感染人的疱疹病毒。有激活B细胞高度增殖的性能,表现为高球蛋白血症,可转变成B淋巴细胞肿瘤。在干燥综合征的患者的泪腺、唾液腺、肾小管上皮细胞内有EB病毒的早期抗原(EA)和DNA,说明在干燥综合征患者体内EB病毒处于活跃复制状态,它不断激活B细胞增殖、分化,使疾病缠绵延续;另有一些学者从正常人的唾液腺活检标本中也测到EB病毒的DNA,因此认为以EB病毒作为本病病因是值得怀疑的。
(2)逆转录病毒:属于逆转录病毒的人免疫缺陷病毒(human immunodeficiency virus,HIV)感染者可出现口干、腮腺肿大等干燥综合征样症状,且30%的干燥综合征患者血清中测到了对HIV成分P24gag蛋白的抗体;在HTLV-1(人T淋巴细胞白血病病毒,为另一种逆转录病毒)感染者亦出现干燥综合征样症状,因此有人认为HIV感染可能是干燥综合征的病因。然而HIV患者虽有口、眼干燥,但血清中不具有抗SSA、SSB抗体,它们与HLA-DR3无关。另外,部分SLE患者血清中也出现抗P24抗体,故不能说明HIV或HTLV-1是干燥综合征的直接病因。
(3)
丙型肝炎病毒:美国文献报道
丙型肝炎病毒在干燥综合征中没有意义,除非伴随有混合性
冷球蛋白血症或其他疾病,如膜增殖性肾炎。法国一份报道发现在原发性干燥综合征中,
丙型肝炎病毒感染在10%左右,这些病毒可出现在唇唾液腺,从而认为
丙型肝炎病毒感染是干燥综合征的病因之一。意大利学者认为
丙型肝炎病毒在干燥综合征自身器官损伤方面没有作用,慢性丙性肝炎其淋巴细胞灶损伤形态与原发性干燥综合征不同。
3.性激素 干燥综合征患者体内雌激素水平升高,且干燥综合征患者大多数为女性,推测与雌激素升高相关。
 发病机制
发病机制
发病机制:
1.细胞免疫
(1)淋巴细胞:
①外周血:淋巴细胞总数及T淋巴细胞CD
4 和CD
8 亚群的数目、比值在70%~80%的干燥综合征患者是正常,但它们的功能可能存在着异常。也有人报道显示CD
8 是减低的。CD
8 中有抑制功能的T细胞数目减少,造成B细胞大量增殖。CD
5 B标记的淋巴细胞在于燥综合征中增高达30%~40%(正常人仅为15%~25%),这种细胞属分化不良或不完全成熟的细胞,它们
自发分泌IgM-RF和抗单链DNA抗体(抗SS-DNA抗体)。因此干燥综合征周围血中的T、B淋巴细胞存在着明显的分化、成熟及功能异常。
②唇腺中:在唇小涎腺组织间质内可以见到大量淋巴细胞聚集成灶,其中以T细胞为主,T细胞中又以具有活化标记的4B4 /CD45RO 的T辅助细胞占优势。4B4 细胞是一种被活化后有辅助记忆功能的T细胞。唇腺中大部分的细胞和导管上皮细胞都表达了HLA-DR分子,进一步说明在干燥综合征唇腺组织内T、B细胞和导管上皮细胞均被活化。在干燥综合征的眼结膜的小泪腺组织中看到了完全相同的变化。
(2)自然杀伤细胞:自然杀伤细胞是一组体积极大的淋巴细胞。在干燥综合征外周血中自然杀伤细胞数目正常,但功能下降,在其外分泌腺体(唇腺)的单核细胞浸润病灶中缺乏这类细胞。
2.体液免疫 干燥综合征患者突出表现是高球蛋白血症和多种自身抗体,反映了其B淋巴细胞功能高度亢进和T淋巴细胞抑制功能的低下。
(1)高球蛋白血症(hyperglobulinemia):95%患者的γ球蛋白都有不同程度的增高,大部分呈多克隆状。免疫球蛋白IgG、IgM、IgA均可增高,其中以IgG增高最多见,IgM或IgA也不少见。也可呈单克隆性增高。少数患者尿中可以出现κ或λ链片段。干燥综合征的高球蛋白血症较其他结缔组织病如
系统性红斑狼疮和类风湿关节炎更为突出。同时在唇腺的局部组织中B淋巴细胞也具有合成大量免疫球蛋白的功能。
(2)自身抗体:由于B淋巴细胞多克隆的增殖,因此本病可产生多种自身抗体。
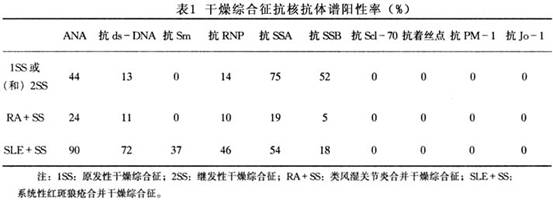
①抗SSA(Ro)抗体和抗SSB(La)抗体:它们与干燥综合征密切相关,也可出现在部分
系统性红斑狼疮的患者,均属IgG型。抗SSA抗体识别的抗原为细胞浆内的小RNA(hy5RNA)相连的60kD和52kD的蛋白质成分。这两种蛋白都属于核糖核蛋白复合物。对52kD起作用的抗体80%来自干燥综合征血清,对60kD起作用的抗体往往来自SLE。约85%干燥综合征同时具有对52kD和60kD起反应的抗体。抗SSB抗体识别的为47kD蛋白,它和60kD、52kD蛋白是不同的细胞内成分。凡有抗SSB抗体者都同时有抗SSA抗体。这是因为SSB分子和SSA连接在一起。SSB的RNA可能和多种蛋白相连,包括70kD、SnRNP的A和B/B蛋白、SSA的60kD蛋白。抗SSA、SSB抗体对干燥综合征的诊断起了极大的作用。
②类风湿因子(rheumatoid factor,RF):RF是具有和IgG-FC段相结合性能的自身抗体,它出现在干燥综合征、类风湿关节炎、
系统性红斑狼疮等多种自身免疫病。在干燥综合征中IgM-RF阳性率约占50%,低于RA(70%),高于SLE(30%)。在我们的干燥综合征病例中RF阳性率占90%以上。IgM-RF也可出现于一些肿瘤、感染等非风湿病。在此它只代表了人体免疫失调,而无特异性。
③其他:抗心磷脂抗体(ACA)(25%),抗线粒体抗体(20%),低滴度的抗双链DNA抗体(抗ds-DNA抗体)(10%),抗RNP抗体等。
④抗器官抗体:干燥综合征患者还可出现抗腮腺导管抗体、抗甲状腺抗体、抗胃体细胞抗体等。
(3)免疫复合物:大约80%的干燥综合征有循环免疫复合物,它们是有大量自身抗体和抗原结合形成并因网状内皮系统清除功能障碍所致。血清冷球蛋白出现,往往代表着有腺体外的损害。
(4)细胞因子:干燥综合征周围血淋巴细胞分泌的细胞因子(IL-1β、IL-6、TNF-α、IFN-γ)和血清内各个细胞因子水平均无明显异常。另有学者报道了血清中IL-2和TNF-α的水平下降。唇腺上皮细胞及单个核细胞内有IL-1β、IL-6、TNF-α、IFN-γ的mR-NA表达。提示细胞因子参与了干燥综合征局部、唇腺炎的发病过程。
(5)免疫功能异常,周围血中的T、B淋巴细胞存在着明显的分化、成熟、功能的异常。干燥综合征的动物模型有胸腺的过早衰退,抑制性T淋巴细胞功能下降,而B淋巴细胞功能亢进出现多种自身抗体,产生免疫损害。人的干燥综合征可能有类似发病机制。
3.病理本病的唾液腺、泪腺以及体内任何器官都可以受累。有两种主要病理改变。
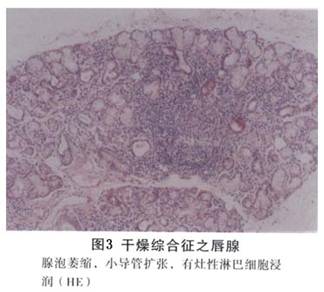
(1)外分泌腺炎:在柱状上皮细胞组成的外分泌腺体间有大量淋巴细胞包括浆细胞及单核细胞的浸润,这种聚集的淋巴细胞浸润性病变是本病的特征性病理改变。它出现在唾液腺(包括唇、腭部的小涎腺)、泪腺(包括眼结膜的小泪腺)、肾间质、肺间质、消化道黏膜、肝汇管区、胆小管及淋巴结,最终导致局部导管和腺体的上皮细胞增生,继之退化、萎缩、破坏,以纤维组织代之,丧失其应有的功能。有人把唾液腺、泪腺以外组织中出现大量的淋巴细胞浸润称之为假性淋巴瘤(图2,3)。
(2)血管炎:由
冷球蛋白血症、高球蛋白血症或免疫复合物沉积所致。是本病并发肾小球肾炎、周围和中枢神经系统病变、皮疹、雷诺现象的病理基础。
 临床表现
临床表现
临床表现:通常分为原发性和继发性两类,前者指仅有干燥性角膜结膜炎和口腔干燥等,而后者同时伴发其他结缔组织病。原发性干燥综合征的临床表现也差异很大,轻者仅有口腔干燥,而重者类及多处黏膜和组织。
1.眼 眼干燥、无泪、发痒或疼痛。有异物感或烧灼感,畏光、视物模糊,角膜可混浊,主要为干燥性角膜炎结膜炎的症状。严重者可并发细菌、病毒、真菌感染,可导致角膜糜烂、溃疡、穿孔,合并虹膜、脉络膜炎。
2.口腔 起病隐袭,不易为患者察觉。表现为唾液分泌减少,常影响食物咀嚼和吞咽,舌红、干燥或有裂隙,活动不便。有的可伴发念珠菌感染。约半数病例可发生腮腺肿大,质地中度硬度。
3.其他黏膜 皮肤干燥、出汗减少或缺如,可有明显的瘙痒。外生殖器、肛门、阴道等皮肤黏膜可干燥或萎缩。鼻黏膜腺体分泌减少,鼻腔干燥、鼻痂形成。咽喉干燥可发生声音嘶哑,痰液黏稠不易咳出。食管干燥可使
吞咽困难。胃液分泌减少形成鹅卵石样假癌。
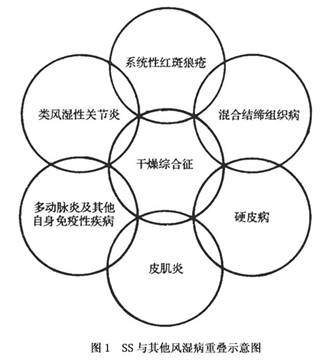
伴发的结缔组织病有类风湿性关节炎、SLE、硬皮病、混合结缔组织病、
桥本甲状腺炎等。另外还可伴发假性淋巴瘤和
恶性淋巴瘤,尤以非Hodgkin淋巴瘤多见。
 实验室检查
实验室检查
实验室检查:
1.血常规 半数病人可出现轻度正细胞性正色素性贫血,个别病人可出现轻度白细胞减少。
2.生化学检查 半数病人可出现血浆白蛋白降低,球蛋白增高。球蛋白升高为多株峰型,主要在γ球蛋白部分,亦可有啦或β球蛋白增高。球蛋白可高达40~60dl,合并多发性肌炎及系统性硬化症者更为明显。
3.免疫学检查 IgM、IgA和分泌型IgA升高,个别病人可发现有巨球蛋白和冷凝集素。由于血液中存有IgG及其复合物,故有时血液黏稠度增加。
50%~60%的病人抗SSA抗体和(或)抗SSB抗体阳性。半数以上病人
类风湿因子阳性。约有33%的病人抗甲状腺和
抗平滑肌抗体阳性。凡是
抗甲状腺抗体阳性的病人,都有
抗胃壁细胞抗体阳性。约半数病人体内存在着抗唾液腺管抗体。约10%的病人狼疮细胞阳性。近年来又发现有对淋巴样细胞渗出液可溶性核酸抗原的沉淀抗体。结核菌素及二硝基氯苯皮肤试验、淋巴细胞转化试验,均提示细胞免疫机能低下。
4.玫瑰红或荧光素染色试验 1%玫瑰红或2%荧光素行角膜结膜染色,可显示出风湿病的重叠有溃疡。用裂隙灯检查可发现部分剥离的角膜上皮丝、角膜碎片或表浅性角膜基质浸润。
5.滤纸试验是检查泪液分泌减少最简单的一种方法。取35mm × 5mm滤纸一张。在其一端5mm处折成直角,将该端置于眼睑结膜囊内,5min后测定滤纸湿浸至折叠处的长度,正常人在15mm以上(图4)。
6.唾液流量测定 先在腮腺管开口处放一个小杯,再向舌边滴柠檬液数滴,5min后收集左右腮腺分泌液,少于0.5ml者为阳性;再咀嚼石蜡4g,并测定10min所分泌的唾液量,正常值为10~20ml,本病患者则减少。
 诊断
诊断
诊断:本综合征根据临床和实验室检查,可明确诊断。诊断原发性干燥综合征和标准至少有5个比较常用,其中发现欧洲的标准有较高的特异性差别(范围97.9%~100%)。患者主诉有明显的眼干燥异物感,角膜荧光素检查和孟加拉玫瑰红染色示角膜和结膜均有染色区;泪膜破裂时间常<5min或10min。若排除与全身结缔组织疾病关系时则为原发性,若同时伴有涎腺及类风湿性关节炎等临床表现则可以确诊为继发性干燥综合征。因本病是一种自身免疫性疾病,患者常有类风湿因子阳性,抗核抗体阳性,血沉增快以及IgA、IgG、IgM升高等。
最常用的原发性干燥综合征诊断标准(欧洲)是下列各项中至少4项:①主诉
干眼;②主诉口干;③涎
腺病理活检;④Schirmer-Ⅰ试验或玫瑰红染色(Rose Bengal staining)异常;⑤没有刺激的涎液测量或涎液图检查异常。
按照干燥综合征诊断的欧洲标准,如下列6项中至少有4项阳性时,有93.5%敏感性(Sen)和94%特异性(Spe)。
1.眼症状定义 下列3个问题至少1个阳性回答。
(1)有否每天感到口干>3个月?
(2)眼部是否常有砂粒感觉?
(3)有否用人工泪液3个月以上?
2.口腔症状 下列3个问题至少1个阳性回答。
(1)有否每天感到口干>3个月?
(2)有无持久或复发性涎腺肿胀?
(3)是否常常需要饮用液体帮助吞咽干燥食物?
3.眼症状 眼受累客观证据,确定下列2项试验至少1项阳性结果。
(1)Schirmer Ⅰ试验(≤5mm/5min)。
(2)玫瑰红试验(≥4,根据van Bijsterveld scoring system)。
4.病理组织学特征。
5.涎腺受累 涎腺受累的客观依据,下列3个试验至少1项阳性。
(1)涎腺闪烁扫描法。
(2)腮腺扫描图。
(3)非刺激的涎液流(≤1.5ml/15min)。
6.自身抗体 流动血清自身抗体至少1项存在。
(1)对Ro/SS-A或La/SS-B抗原的抗体。
(2)抗核抗体。
(3)风湿因子。
日本的诊断标准:3项中有不明原因的
干眼症状必须有2项满足。①当Schirmer-Ⅰ和van Bijsterveld score和(或)荧光素染色异常。②泪腺或涎
腺病理活检。③病理性泪液图。不需自身抗体存在。
 鉴别诊断
鉴别诊断
鉴别诊断:要注意与引起腮腺肿胀的疾病鉴别。
1.
系统性红斑狼疮 虽然该病与SS的共同之处是两者均为自身免疫性风湿病,抗核抗体、抗RNP抗体、抗SSA抗体和抗SSB抗体阳性,但通过检查抗dsDNA抗体、抗Sm抗体及临床表现不难鉴别。应注意60%的病人两病重叠。
2.类风湿关节炎 两病的共同特点是均可出现类风湿因子阳性,类风湿关节炎的关节病变是一种侵蚀性关节炎,与SS鉴别较易,但应注意有60%~70%类风湿关节炎病人与SS重叠。
3.肾小管酸中毒 对于不明原因的肾小管酸中毒,应高度警惕SS继发的可能。
4.
流行性腮腺炎 多见于儿童,呈流行性,与感染源接触经2~3周潜伏期才发病,病情不反复。症状在1周左右减轻,有时也可伴有关节炎,关节炎也可在数周内减轻。
5.化脓性
腮腺炎 多见于成人及
糖尿病患者,在机体抵抗力下降时发病,大部分为一侧性,有发热、白细胞增加及局部明显的炎症表现。
6.腮腺恶性肿瘤 单侧性缓慢增大,如侵犯面神经,可引起
面神经麻痹。
7.慢性肉芽肿 由结核、结节病、霉菌引起的腮腺慢性肉芽肿,鉴别较困难,有时需依靠病原学及病理检查加以鉴别。



 流行病学
流行病学
 病因
病因
 发病机制
发病机制

 临床表现
临床表现
 并发症
并发症
 实验室检查
实验室检查

 其他辅助检查
其他辅助检查

 诊断
诊断
 鉴别诊断
鉴别诊断
 治疗
治疗
 预后
预后
 预防
预防